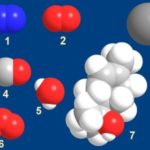
 Поскольку неполярные вещества удерживаются вместе слабыми ван-дер-ваальсовыми взаимодействиями, а молекулы воды используют сильные водородные связи, ван-дер-ваальские взаимодействия неполярных веществ недостаточно сильны для разрушения водорода связей молекул воды. Соответственно, неполярное вещество не может рассеиваться в воде.
Поскольку неполярные вещества удерживаются вместе слабыми ван-дер-ваальсовыми взаимодействиями, а молекулы воды используют сильные водородные связи, ван-дер-ваальские взаимодействия неполярных веществ недостаточно сильны для разрушения водорода связей молекул воды. Соответственно, неполярное вещество не может рассеиваться в воде.
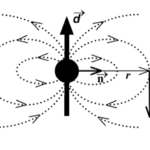
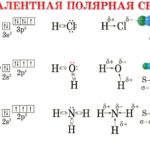
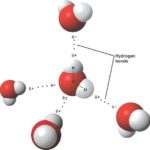
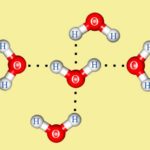
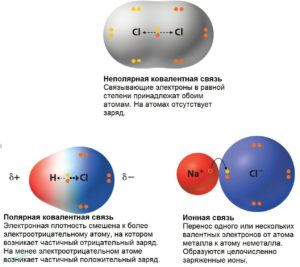
Вода — полярная молекула, потому что она состоит из водорода и кислорода, которые имеют разные электроотрицательности. Электроотрицательность атома заключается в его стремлении вытащить связанную пару электронов ближе к себе, тем самым давая атому частичный отрицательный заряд. Кислород имеет более высокую электроотрицательность, чем водород, и тянет связанные электроны к себе, что дает кислород частичный отрицательный заряд, а атомы водорода — частичный положительный заряд. Кислород, что одна молекула воды оказывает привлекательную силу, которая называется водородной связью, на атоме водорода другой молекулы воды.
Водородные связи могут быть разрушены только другими полярными молекулами, которые имеют частичный положительный заряд и частичный отрицательный заряд. Частичные заряды дают полярной молекуле возможность вставлять себя между молекулами воды и, таким образом, рассеиваться по раствору. Эта дисперсия является так называемой растворимостью.
Неполярные вещества удерживаются вместе слабыми индуцированными дипольными моментами. Они называются силами Ван-дер-Ваальса. Они постоянно колеблются и являются временными диполями, в отличие от воды и других полярных веществ, которые являются более сильными, постоянными диполями. Сила, оказываемая ван-дер-ваальсовыми взаимодействиями, недостаточно сильна, чтобы разрушить водородные связи между молекулами воды. Это означает, что неполярные молекулы не могут встать между молекулами воды и оставаться изолированными или нерастворимыми в воде.