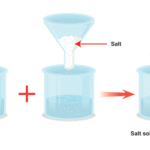
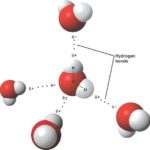
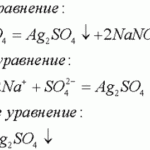Вода растворяет соль путем диссоциации ионов в соли друг от друга. Поскольку вода является полярной молекулой, каждый ее конец имеет небольшой положительный или отрицательный электрический заряд. Эти цели привлекают положительные и отрицательные ионы в соли и отделяют их друг от друга.
Вода растворяет соль путем диссоциации ионов в соли друг от друга. Поскольку вода является полярной молекулой, каждый ее конец имеет небольшой положительный или отрицательный электрический заряд. Эти цели привлекают положительные и отрицательные ионы в соли и отделяют их друг от друга.
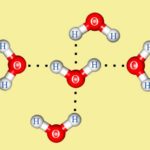
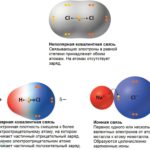
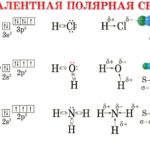
Полярность воды исходит из различий в электроотрицательности в атомах, участвующих в процессе склеивания. Когда ковалентно связанные атомы имеют различие в электроотрицательности, электроны распределяются неравномерно в связи и приводят к противодействию слегка отрицательным и положительным заряженным концам. В воде положительный конец состоит из атомов водорода, а отрицательным концом является атом кислорода. При взаимодействии с хлоридом натрия — общая поваренная соль — положительный ион натрия отводится к кислородному концу воды и отрицательному ионам хлорида к концу водорода.
Хотя обычная поваренная соль легко растворяется в воде, не все ионные соли. Если сила притяжения между ионами намного больше, чем сила, создаваемая небольшими зарядами молекулы воды, ионы остаются связанными в воде. Набор установленных правил, известный как правила растворимости, дает общие рекомендации и исключения при определении того, является ли ионное соединение или соль водорастворимым.