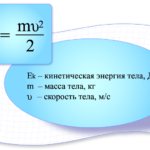
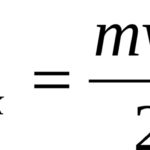Реальные газы отличаются от идеального поведения, потому что, когда они установлены при низких температурах и высоких давлениях, реальные газы не соответствуют двум предположениям кинетической молекулярной теории. Голландский физик Йоханнес ван дер Ваальс первым разработал объяснение реальных отклонений газа.
Реальные газы отличаются от идеального поведения, потому что, когда они установлены при низких температурах и высоких давлениях, реальные газы не соответствуют двум предположениям кинетической молекулярной теории. Голландский физик Йоханнес ван дер Ваальс первым разработал объяснение реальных отклонений газа.
Кинетическая молекулярная теория имеет два предположения для реальных газов, которые вызывают проблемы при низких температурах и высоких давлениях (как в реальных газах, отклоняются от этого поведения идеи). Кинетическая молекулярная теория предполагает, что частицы газа будут занимать лишь небольшую часть от общего объема газа. Во-вторых, теория предполагает, что молекулы газа не будут иметь притяжения.
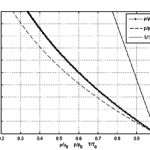
Первое предположение справедливо только при давлениях, составляющих примерно один атм. Однако, когда сжатие газа увеличивает давление, это предположение больше не работает; реальный объем газа становится больше, чем предполагает идеальное уравнение газа.
Второе предположение неверно, потому что, если между газовыми частицами не было никакого притяжения, этот газ никогда не мог стать жидкостью, которая требовала бы его конденсации. На самом деле существует мизерная сила притяжения, удерживающая молекулы вместе. Когда температура падает, настоящие газы становятся жидкостями, игнорируя предположения о идеальном поведении.